2024年2月1日からTASCLの販売を再開します。
三次元培養マイクロプレート「TASCL」(タスクル)とは

TASCL(Tapered Stencil for Cluster Culture、タスクル)は、大学発の微細加工技術と表面処理技術をもとに開発された、細胞塊三次元培養マイクロプレートです。特長は、ほぼ均質な形状・大きさの細胞塊(スフェロイド・胚様体)を一度に大量培養できること、約1ヵ月の長期培養により同一器材で分化誘導が可能なこと、培地交換など使い方が簡単で培養途中でTASCL上の細胞塊の顕微鏡観察ができること、培養密度が高いため、培地・試薬のコストが安く抑えられることです。
三次元培養マイクロプレートTASCLのパッケージ

三次元培養マイクロプレートTASCLは現状は現状、研究用途としてお使いいただけます。TASCLで培養した細胞塊をヒトに投与することは、臨床研究の例外を除き認められていません。臨床研究についてはご相談ください。
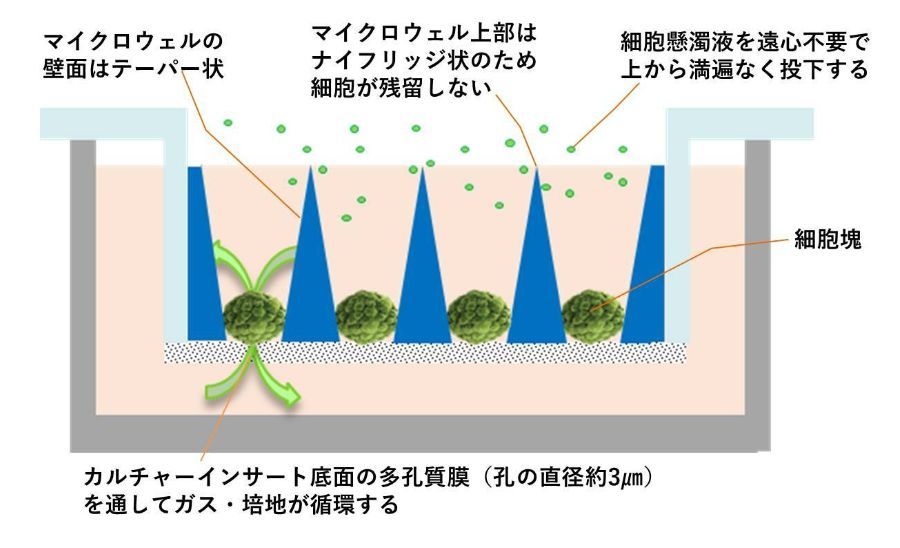
TASCLのマイクロウェル部分の底は穴が貫通しており、カルチャーインサートの多孔質膜を通じてガス・培地が拡散され、細胞塊・スフェロイドの生存率が向上します。
そのため1ヵ月程度の長期培養も可能であり、同一器材上で分化誘導まで実施することができます。
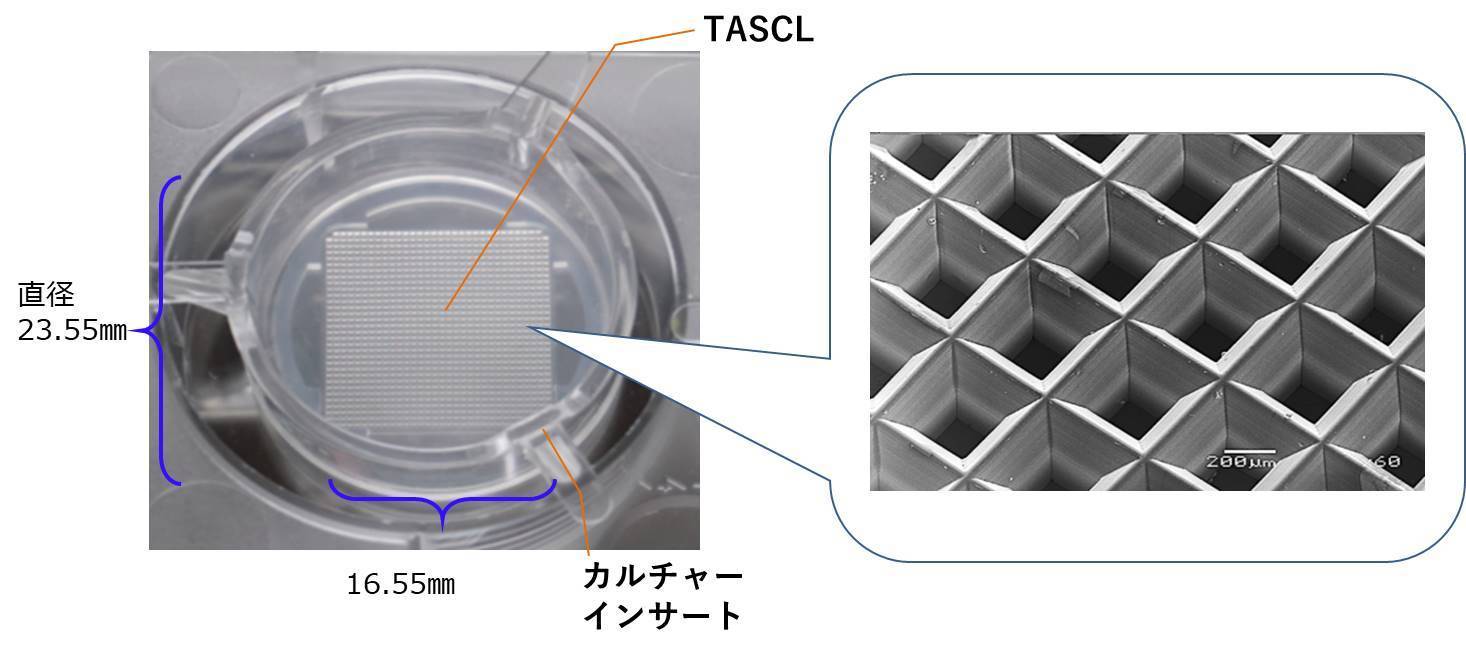

細胞塊・スフェロイド三次元培養マイクロプレートTASCLの8つの特徴
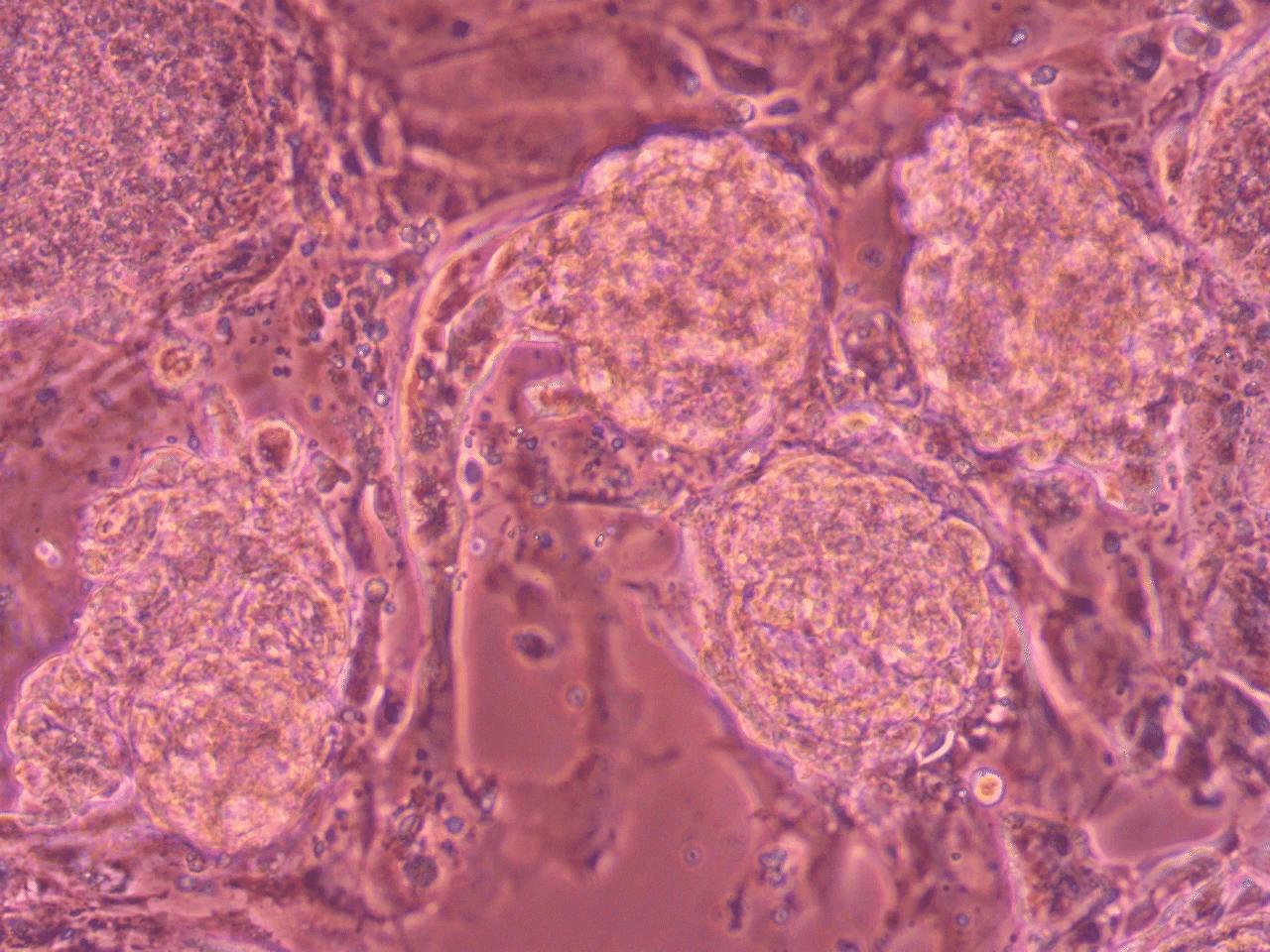
①ほぼ均一な形状・大きさ・品質の細胞塊を一度に大量に三次元培養できる
・・・TASCL600ウェルでは約3600個、TASCL1000ウェルでは約6000個
なお、マイクロウェルの5%までは細胞塊が形成できないことを品質水準として織り込んでおりますことをご了承ください。
②細胞塊・スフェロイドの状態を長く良好に保つことができる
・・・底面が貫通、ガスや培地が循環するため
③同一器材で細胞塊培養から分化誘導までできる
・・・ガスや培地が循環することで1ヵ月間もの長期培養ができるため
④培地・試薬のコストを削減できる
・・・高密度のウェル構造のため培地・試薬の使用量が少なくて済む
⑤開けてすぐに使える
・・・細胞接着抑制コーティング処理済(有効期限は製造から2年間)
・・・25kGy~50kGyガンマ線照射済み
⑥培地交換が容易など、簡単に使える
・・・播種は細胞懸濁液を上から播くだけ(遠心分離不要)
・・・培地交換の際に細胞塊に触れないため培地交換が容易(細胞塊をこぼしてしまうことが無い)
⑦培養中でもTASCL上で細胞塊の観察が容易にできる
・・・TASCLに載せたまま細胞の顕微鏡観察も可能
⑧共培養の細胞塊も三次元培養しやすい
・・・2,3種類の細胞を共培養した細胞塊も形成しやすい
TASCLのアプリケーションノート
1. iPS細胞培養ディッシュコート方法(通常)
2. iPS細胞培養ディッシュコート方法(簡単)
3. iPS細胞解凍法(緩慢法)→増殖培養開始方法
4. iPS細胞凍結方法(緩慢法)
5. iPS細胞凍結方法(急速法)
6. 脂肪組織幹細胞軟骨細胞分化誘導法
7. iPS細胞心筋分化誘導法
(クリックで拍動の動画をご覧いただけます)
日本ジェネティクスによるTASCLのアプリケーションノート
「TASCLを用いた、がん幹細胞の幹細胞性の評価方法」 (関西医科大学 生理学講座 林 美樹夫先生)
TASCLを利用したアルギン酸ゲル上での3次元培養スフェロイドアレイ
TASCLを使用した大細胞塊の作成
スフェロイド作製を容易にするTASCLカルチャーインサート
細胞塊三次元培養マイクロプレートTASCLの特長
再生医療において、細胞を三次元培養して細胞塊・スフェロイドとして用いることには様々な有用性があります。
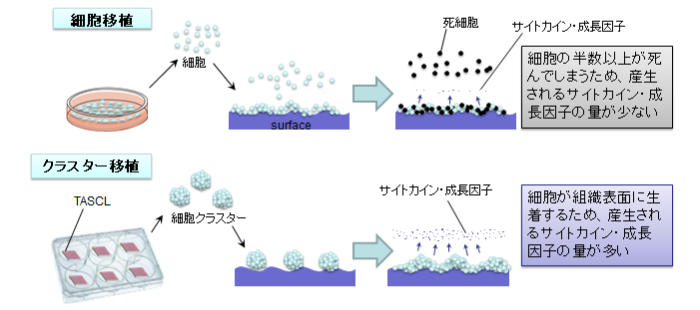
細胞塊を三次元培養する方法としては、ハンギングドロップ法や細胞非接着性培養器材を用いる方法、浮遊回転培養などがあります。
しかしながら、方法が複雑、培地交換が難しい、細胞塊のサイズ・形状・品質が不均質になる、などの問題がありました。つまり、ほぼ均質なサイズ・形状・品質の細胞塊・スフェロイドを大量に三次元培養することが困難だったのです。
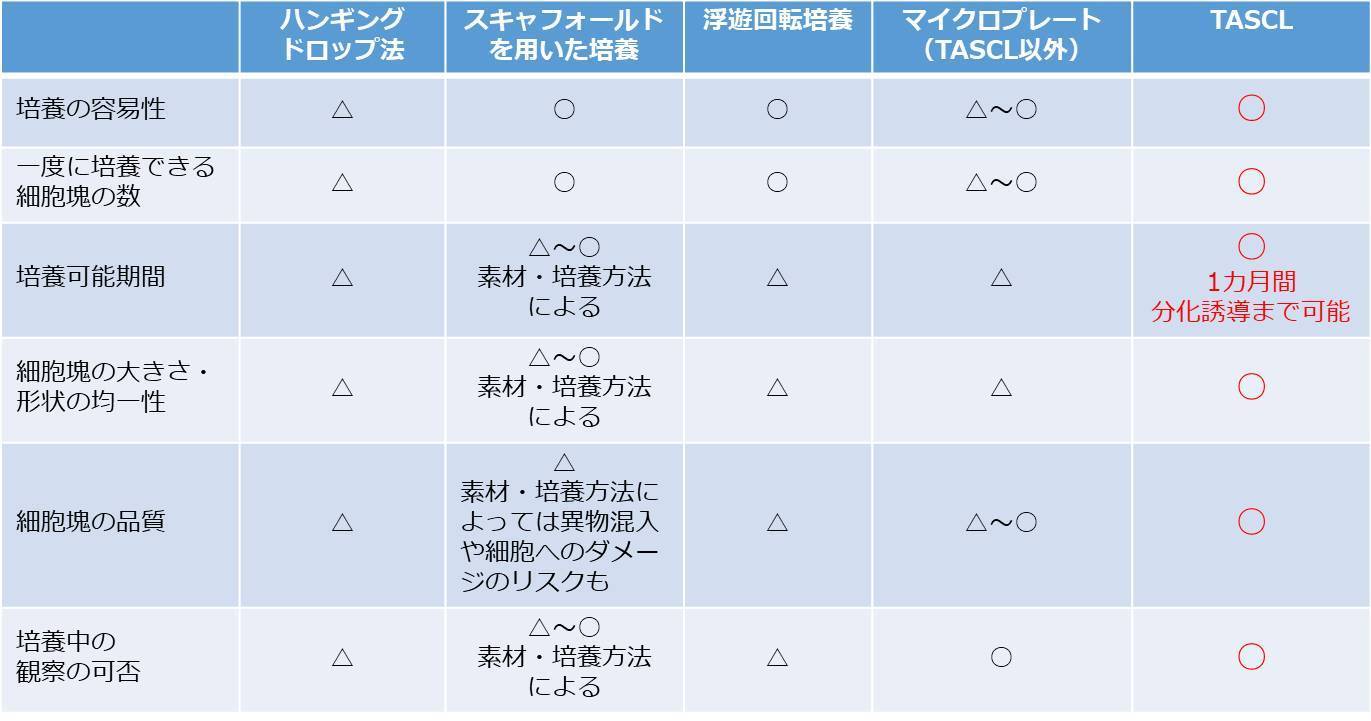
この問題解決のために開発された細胞塊・スフェロイド三次元培養マイクロプレートが、TASCLです。上から細胞を含む懸濁液を振りかけるだけで、ほぼ均質な大きさ・形状の細胞クラスターをTASCL本体1つで約1000個または約600個(6穴プレート1セットで約6000個または約3600個)程度を三次元培養・分化誘導することができます。
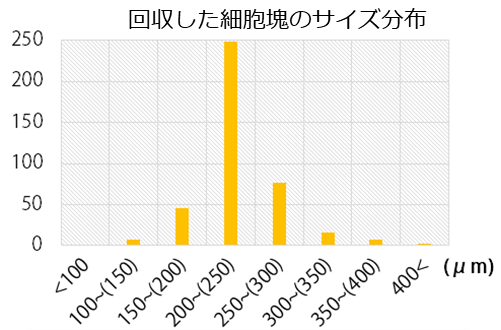
TASCLは、ほぼ均質な大きさの球状の細胞塊(スフェロイド)を一度に6000個または3600個ほど三次元培養することができます。
この均一性は他のマイクロウェルにはないものです。
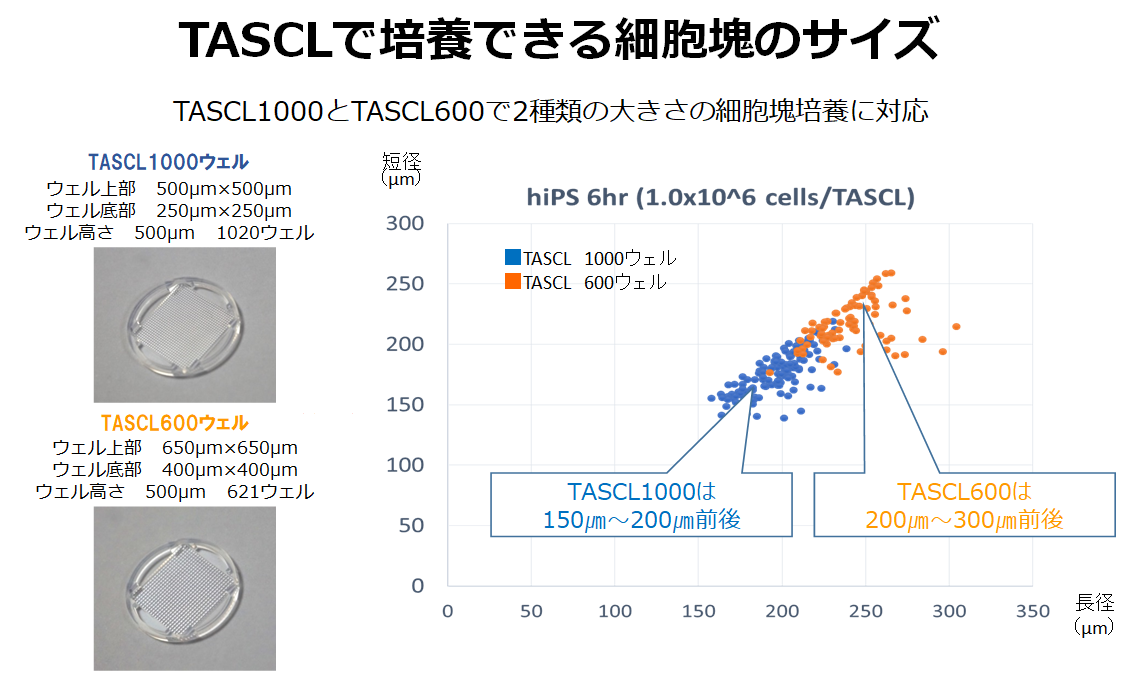
TASCLはマイクロウェルの大きさが異なるTASCL1000ウェルとTASCL600ウェルの2つの商品があります。
TASCL1000は、直径150㎛~200㎛の細胞塊培養に向いています。TASCL本体1つのウェル数は1020のため、TASCL本体が6つある6穴プレート1セットでは約6000個の細胞塊・スフェロイドを三次元培養することができます。
TASCL600は、直径200㎛~300㎛の細胞塊培養に向いています。TASCL本体1つのウェル数は621のため、TASCL本体が6つある6穴プレート1セットでは約3600個の細胞塊・スフェロイドを三次元培養することができます。
TASCLの仕様
| 製 品 | TASCL 1000ウェル | TASCL 600ウェル |
| 型 番 | TASCL1000 | TASCL600 |
| セット内容 | 6ウェルプレート1個 カルチャーインサート6個 TASCL1000ウェル6個 |
6ウェルプレート1個 カルチャーインサート6個 TASCL600ウェル6個 |
| サイズ | 直径23.5㎜の円形 | 直径23.5㎜の円形 |
| ウェル数 | 1020 | 621 |
| ウェルのサイズ | ウェル上部 500μm×500μm ウェル底部 250μm×250μm ウェル高さ 500μm |
ウェル上部 650μm×650μm |
| 1ウェルあたりの 培養細胞個数の目安 |
500個~3000個 | 2,000個~10,000個 |
| 有効期限 (細胞接着抑制コーティング剤の有効期限) |
製造から24ヵ月 | 製造から24カ月 |
| 出荷前ガンマ線照射 | 25kGy | 25kGy |
細胞塊三次元培養マイクロプレートTASCLの推薦コメント
TASCLは細胞塊移植の研究に役立ちます
名古屋大学名誉教授、名古屋共立病院リウマチ・人工関節センター長
岩田 久 先生
整形外科分野の再生医療の例として、軟骨などの欠損部への細胞移植治療が研究されています。そこで、細胞の代わりに、細胞塊を移植すると、より生着率が高まり、治療効果が上がるのではないかと期待されています。TASCLは小さなプレート上で、均質な細胞塊を大量に培養できるため、このような移植治療の研究に役立ちます。

TASCLは従来品より使いやすく失敗のリスクがほとんどありません
愛知医科大学 整形外科 教授(2021年当時)
(現 愛知医科大学名誉教授、広島市立広島市民病院副院長)
出家 正隆 先生
当研究室では細胞塊移植の前臨床研究に取り組んでいます。細胞塊を培養するためにTASCLを使いましたが、初めて使うスタッフでも、球状の細胞塊を容易に培養することができました。
従来品と比べてとても使いやすく、失敗のリスクもほとんどありません。細胞塊を用いる実験には便利なツールだと言えます。

三次元培養(3D Culture)とTASCL
細胞培養は当初、平面(二次元)の環境で行われてきました。やがて1970年代頃から、生体内により近い環境を実現するため、あるいは組織および器官を再生するために、三次元培養が手掛けられるようになりました。三次元培養による細胞塊(スフェロイド)は、細胞間結合により細胞間コミュニケーションがなされ、細胞と細胞外基質とのシグナルも再現できます。三次元細胞塊(スフェロイド)で行われた実験は、より生体内環境を再現していると考えられています。三次元培養は、「スキャフォールド型培養」と「スキャフォールドフリー型培養」に分けられます。
スキャフォールド型培養は、コラーゲンや高分子ハイドロゲル、ポリスチレンなどのスキャフォールド(scaffold)に細胞が付着して増殖や分化することができます。スキャフォールドフリー型培養に比べると、生体にとって不純物であるスキャフォールドを用いるため、細胞への影響やコンタミネーションのリスクが相対的に高いと言えます。
スキャフォールドフリー型培養は,細胞に対する足場(スキャフォールド、scaffold)がない状態で細胞塊(スフェロイド)を培養します。バイオリアクターによる培養や、マイクロプレートによる培養があります。バイオリアクターを用いた培養は、細胞塊(スフェロイド)の形状や大きさにバラつきがあります。
TASCLは、浮遊型培養のマイクロプレートによる培養に該当します。細胞はカルチャーインサートあるいはTASCLの表面に接しますが、これらの表面には細胞接着抑制コーティング処理が施されているため、これらに接着するわけではありません。
TASCLに関するよくある質問(FAQ)
Q.TASCLで三次元培養した細胞塊(スフェロイド)の回収はどのようにすればよいですか?
A.ピペットで培養液ごと強めに吸い取っていただくか、
またはピンセットでTASCLをカルチャーインサートからはがし、
培養液で細胞塊を洗い流すようにして、培養液ごと回収します。
Q.TASCLはどのような種類の細胞の三次元培養に用いることができますか?
A.再生医療の研究で一般的に用いる接着性の細胞であれば、
種類を問わず培養できます。
一例として下記の細胞については実績があります。
・ hiPS細胞(複数株)
・ hiPS由来心筋細胞(正常、疾患)
・ HepG2細胞
・ MIN6細胞
・ ヒト由来幹細胞
・ ヒト膝軟骨細胞
・ マウスES細胞(複数株)
・ マウス初代肝細胞
・ マウス初代心筋細胞
なお、浮遊性の細胞の培養には向いていません。
Q.TASCL上の細胞塊を顕微鏡で観察できますか?
A.TASCLマイクロウェル、6穴プレート、カルチャーインサートは
光学的に透明ですので、倒立顕微鏡でそのまま観察していただけます。
対物レンズとの作動距離を3mm程度確保する必要があるため、
一般的な倒立顕微鏡の対物レンズの4倍~20倍であれば
TASCLのままで観察していただけます。
Q.TASCL上の細胞塊を蛍光染色はできますか?
染色はどのようにすればよいですか?
A.蛍光染色できます。
各種染色試薬のマニュアル通りのプロトコルで結構ですが
注意事項として下記の点がございます。
TASCL上での各種染色をする際の注意点は、
常に試薬がカルチャーインサートの上から下(表から裏)に
流れるように操作することです。
一つの簡易的な方法は、TASCL/カルチャーインサートを
ウェルプレートから取り出し、滅菌したドレープなどの上において
TASCL内の液体を目的の試薬と置換していくことです。
液面が常にTASCLの上面を超えない程度に、滴下速度を調整します。
固定や染色等、試薬を入れたまま待ち時間が必要な場合は、
カルチャーインサートをドレープから離して、
宙に浮いた状態にしておけば、表面張力で液体は保持されます。
量子ドット、あるいはその他のライブイメージング用蛍光試薬を
播種前、あるいはEB培養中の培地に添加しておくのも良いです。
2次元培養で使用している免染や特殊染色をTASCL上で行うことも
可能です。
なお、細胞塊を球体のまま染めても、定量的染色はできません。
染まり具合の比較など、定量的議論が必要な際は、
やはり固定して切片にしてから染色すべきです。
その際には、細胞塊包埋用ゲルを用いると便利です。
Q.TASCLで三次元培養した細胞と、2次元培地で培養した細胞でELISA試験を
行いたいのですが、2次元培地と比較して手技的な違いはありますか?
A.特に手技の違いはありません。
Q.TASCL1000ウェルとTASCL600ウェルはどのような用途を想定していますか?
A.TASCL1000ウェルは、
ウェルあたりの培養細胞数の目安は500個~3,000個で、
再生医療の研究における各種細胞の三次元培養・分化誘導に
用いることを想定しています。
TASCL600ウェルは、
1ウェルあたりの培養細胞数の目安は2,000個~10,000個で、
TASCL1000ウェルよりも大きな細胞塊が培養できるため、
三次元スフェロイドやオルガノイドの形成に向いています。
Q.TASCLの滅菌はどのようにしていますか?
A.出荷前に袋および段ボール箱にパッケージされた状態で
ガンマ線25kGy~50kGyを照射しています。
Q.細胞混濁液の播種量の目安はどの程度ですか。
また、播種時の注意事項はありますか。
A.細胞懸濁液の量は500uLを標準として、多少上下しても問題ありません。
その他注意事項としては、インサートの内側に細胞懸濁液(500uL)を
播種した後、細胞が沈降するのを待ってから、
インサートの外側(ウェル部分)に液面がTASCLの上面と
同じくらいになる程度に培地を追加するということです。
Q.細胞塊をTASCLからはがすときにうまく行える方法など
ありますでしょうか。
A.次の方法があります。
a) 細胞塊がTASCL側に接着している場合
TASCLをピンセット等で把持してインサートから剥がし、
緩衝液などが入った6ウェルプレートや遠沈管の中で
ピペットの水流により落とします。
b) 細胞塊がインサート膜側に接着している場合
TASCLをピンセット等で把持してインサートから剥がし、
インサート表面に残っている細胞塊をスクレーパーなどで
こすり落とします。
Q.三日月形状の窪み部分は何に使いますか?
また、細胞懸濁液を播種時にこの穴に細胞が入り、
不純物となって、マイクロウェルに混入することはありませんか?
A.この窪みは、細胞懸濁液を滴下した後、培養液を追加注入したり、
吸引したりするための窪みです。
細胞懸濁液を滴下した後、培養液をマイクロウェルの上から
注入・吸引すると、マイクロウェルから細胞が出てしまう
恐れがありますので、この窪みで培養液の量を調整します。
この窪みとマイクロウェルの間は壁で仕切られているため、
窪みに不純物が残ったとしても、水平に保たれていれば、
マイクロウェル側に流れることはありません。
Q.細胞塊は上段のカルチャーインサートのメンブレン(浸透膜)上に
ありますが、細胞塊から出たタンパク質や酵素などは
下段まで通過しますか?
A.タンパク質分子のサイズは~10nm程度、
酵素のサイズは~20nm程度ですので、
カルチャーインサート(PETメンブレンのポアサイズ 3.0μm)を
通過します。
Q.細胞塊がカルチャーインサートのメンブレン上にできますが、
細胞塊にならなかった細胞はどうなりますか?
A.細胞塊形成が上手く行っていれば、細胞塊にならなかった周りの
小さな細胞の数は、細胞塊を構成する細胞数に対して
数%になると思います。一般的な実験であれば無視できるレベルです。
それが無視できないレベルの、微小な差を検出する実験系の場合は、
細胞塊形成後に、別容器に取り出して解析していただければと存じます。
Q.TASCLの構成・サイズ、マイクロウェルのサイズも教えて下さい。
A.次の通りです。
①TASCL 600ウェル
6穴プレート1個に、TASCL6個、カルチャーインサート6個。
マイクロウェル:上部650μm×650μm。底部400μm×400μm。
高さ500μm。マイクロウェル数1,020。
おおよそ150μm~200μmの細胞塊培養に適している。
②TASCL 1,000ウェル
6穴プレート1個に、TASCL6個、カルチャーインサート6個。
マイクロウェル:上部500μ,×500μm。底部250μm×250μm。
高さ500μm。マイクロウェル数621。
おおよそ200μm~300μmの細胞塊培養に適している。
Q.TASCLの購入方法(最低購入数も)・支払い方法を教えて下さい。
A.TASCLを購入されたい時には、弊社お問合せ先へご連絡ください。
最低購入数は、600ウェル、1,000ウェル共に1セット
(6穴・6カルチャーインサート・TASCL/1セット)です。
お支払い方法は、担当の販売代理店様、あるいは、弊社より
お知らせいたします。
Q.TASCLを注文しましたら、どのくらいで手元に届きますか。
A.販売代理店へ注文される場合は、当該販売代理店様へご確認ください。
弊社からはご注文から1週間以内に発送します(日本国内の場合)。
弊社から直接購入していただく場合は、
ご注文から1週間以内にお手元に届くよう発送します(日本国内の場合)。
在庫が不足する場合は、改めてご連絡を差し上げます。
Q.TASCLの有効期限を教えて下さい。
A.TASCLの有効期限は、製造日から起算して2年間です。
これは細胞接着抑制コーティング処理剤の期限が2年間であるためです。
(従来、製造から1年間でしたが、2年間に延長しました。2022年9月1日)
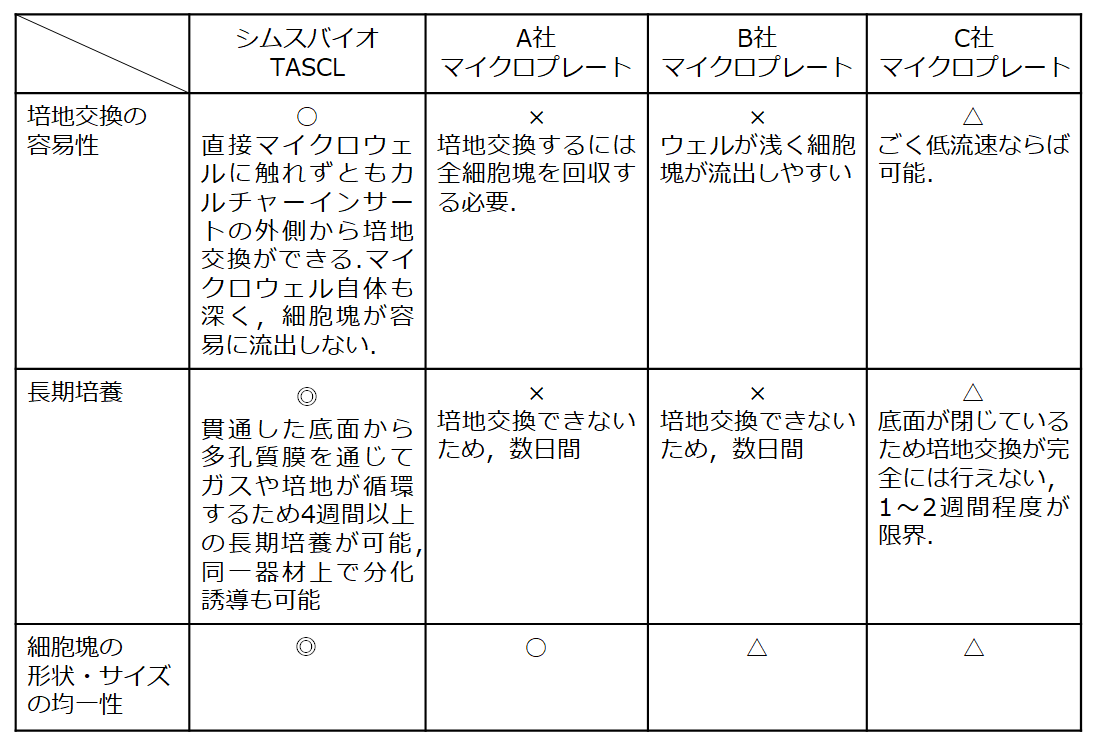
Q.他社の細胞培養マイクロプレートや三次元培養用器材と比較して、
TASCLのメリットを教えてください。
A.TASCLは、マイクロウェルの底部が貫通していることや、
精緻で均一な構造をしていることから、次のメリットがあります。
1) 細胞懸濁液を上から滴下するだけで、大きさ・形状・品質が均一な
細胞塊を一度に「約3600個(600ウェルの場合)」または
「約6000個(1000ウェルの場合)」培養できます。
細胞懸濁液に遠心分離は不要です。
2)使い方が簡単で、細胞培養初心者でも、
大きさ・形状・品質が均一な細胞塊を容易に培養することができる。
3) TASCLの底面が多孔質のため、ガスや培地が循環する。
そのため、1ヶ月以上の長期培養ができ、分化誘導も可能。
4) TASCLはピンセットで引っ張ればカルチャーインサートから
剥がせるため、任意の培養器材と組み合わせて使用できる。
5) ウェルの深さが、細胞塊の直径以上に深いため、
培養液交換の際の細胞化のロスがほとんど発生しない。
(細胞塊の流出が防止される)。
6)1.65cmに約600個または約1000個のウェルのため、
密度が高く培地や試薬のコスト削減に繋がる。
7)滅菌および細胞接着抑制コーティングが施されており、
開封してすぐに使用できる。
ただし気泡が多く発生していたら、気泡除去を行う必要があります。
8) TASCLに載せたまま細胞塊を顕微鏡で観察できる。
TASCL、カルチャーインサート、6穴プレートは
光学的に透明であるため、TASCLを載せたまま細胞を顕微鏡観察
することができる。
Q.TASCLで三次元培養した細胞塊を、人に投与してもよいでしょうか。
A.現状、TASCLは試験研究用として販売しておりますので、
TASCLで培養した細胞塊をヒトに投与することは、
臨床研究の例外を除き認められていません。
なお、例外として、再生医療等安全性確保法のもと、
所定の手続きを経て、TASCLで三次元培養した細胞塊をヒトに投与する
臨床研究を行っている例もあります。
臨床研究についてはお問い合わせください。
TASCL・細胞塊三次元培養に関する研究成果・特許
学会発表
弊社役職員が参加したTASCL、三次元培養、細胞塊、細胞培養・細胞加工技術や細胞移植に関する学会発表の成果です。
- 「細胞塊培養デバイスTASCLと機械学習を利用した量産細胞塊の品質予測」発表学会:2019/11/8~9、第46回日本臓器保存生物医学会学術集会、発表者:須田修矢、青山千裕、池内真志
- 「新規再生医療デバイス TASCL(タスクル)を用いた細胞塊治療 ―基礎から臨床へ―」 発表学会:2019/3/23 第18回日本再生医療学会総会 共催学術セミナー、発表者:池内真志
- 「独自開発した胚葉体培養デバイスTASCLを用いた幹細胞クラスター長期培養法と分化誘導法の開発」 発表学会:2018/3/21-23 第17回日本再生医療学会総会(パシフィコ横浜)
- 「胚様体大量培養デバイス TASCL(Tapered Stencil for Cluster Culture)を用いた幹細胞クラスター長期培養法」 発表学会:2017/11/10 第44回 日本臓器保存 生物医学会 学会集会(大阪大学中之島センター)
- 「3次元培養デバイスTASCLを用いた胚様体形成プロセスの評価」 発表学会:2017/3/7-9 第16回日本再生医療学会(仙台)
- 「胚様体大量培養デバイスTASCLを用いた幹細胞クラスターの長期間培養法の検討」 発表学会:2017/3/7-9 第16回日本再生医療学会(仙台)
- 「胚様体大量生産のための新規エラストマー培養アレイの開発」 研究者:池内真志、木部龍太、豊田悠司、生田幸士、林衆治 発表学会 2013/3/21-23 第12回日本再生医療学会総会(横浜)
- 「細胞への多糖磁性粒子複合体の付着・取り込みとTEM評価解析」 研究者:宮本義孝、斉藤弘明、野口洋文、村瀬勝俊、林 衆治 発表学会:2012/11/16-17 第39回日本臓器保存生物医学会学術集会(福島)
- 「細胞パターニングデバイスによる初代肝細胞スフェロイドの構築」 研究者:宮本義孝、池内真志、湯川博、鈴木聡、岩田久、生田幸士、林 衆治 発表学会:2011/3/1-2 第10回日本再生医療学会総会(東京)
- 「Quantum dots based imaging of adipose-derived stem cells for srem cell therapy.」
研究者:Wartanabe M, Yukawa H, Kagami Y, Kaji N, Okamoto Y, Miyamoto Y, Tokeshi M, Hayashi S, Baba Y 発表学会:2010/12/15-20 2010 International Chemical Congress of Pacific Basin Societies (PACIFICHEM 2010), - 「膵島再生に向けたコンビナトリアル3次元培養デバイスの開発」 研究者:池内真志、大石幸一、野口洋文、宮本義孝、林 衆治、生田幸士 発表学会:2010/11/19-20 第37回日本臓器保存生物医学会(新潟)
研究論文
弊社役職員が参加したTASCL、三次元培養、細胞塊、細胞培養・細胞加工技術や細胞移植や細胞移植に関する研究成果です。
- Yoshitaka Miyamoto, Yumie Koshidaka, Katsutoshi Murase, Shoichiro Kanno, Hirofumi Noguchi, Kenji Miyado, Takeshi Ikeya, Satoshi Suzuki, Tohru Yagi, Naozumi Teramoto and Shuji Hayashi, "Functional Evaluation of 3D Liver Models Labeled with Polysaccharide Functionalized Magnetic Nanoparticles", Materials, Nov. 2022, doi: 10.3390/ma15217823
- 江崎 ゆり子, 須田 修矢, 池内 真志「高密度培養デバイスと3次元CNNを用いたhiPS胚様体の生産効率化」, 生体医工学, 2021年 Annual59 巻 Abstract 号 325, 2021/10/17, https://doi.org/10.11239/jsmbe.Annual59.325
- 野口 洋文, 池内 真志, 潮平 知佳,「TASCLを用いた人工膵幹細胞からインスリン分泌細胞への分化誘導法の開発」, 科研費基盤(C)実施状況報告書, 2021/3/31, https://kaken.nii.ac.jp/grant/KAKENHI-PROJECT-19K09051/
- 河野 菜摘子, 中林 一彦, 池内 真志, 宮本 義孝,「凍結細胞の運命:バイオインフォマティクスに基づく医療用細胞の品質評価技術の構築」, 科研費基盤(B)研究成果報告書, 2021/3/31, https://kaken.nii.ac.jp/report/KAKENHI-PROJECT-18H03556/18H03556seika/
- 青山 千裕, 池内 真志「均質な細胞塊を包埋したアルギン酸ゲルシートの作成」,生体医工学, 2019年 Annual57 巻 Abstract 号 S80_1, 2019/12/27, https://doi.org/10.11239/jsmbe.Annual57.S80_1
- 須田修矢,青山千裕, 池内真志「細胞塊培養デバイスTASCLと機械学習を利用した量産細胞塊の品質予測」Organ Biology26 (3)106-106, 2019.
- 宮本 義孝, 池内 真志, 河野 菜摘子「二次元培養から三次元培養への潮流~細胞培養技術の変遷~」Organ Biology 27(1), 37-52, 2019 一般社団法人 日本臓器保存生物医学会 https://www.jstage.jst.go.jp/article/organbio/27/1/27_37/_article/-char/ja/
- Yoshitaka Miyamoto, Ph.D., Masashi Ikeuchi, Hirofumi Noguchi, Tohru Yagi, Shuji Hayashi, "Enhanced Adipogenic Differentiation of Human Adipose-Derived Stem Cells in an in vitro Microenvironment: The Preparation of Adipose-Like Microtissues Using a Three-Dimensional Culture", Cell Medicine, Jan. 2017, doi:https://doi.org/10.3727/215517916X693096
- Yoshitaka Miyamoto, Masashi Ikeuchi, Hirofumi Noguchi, Tohru Yagi, and Shuji Hayashi, Cell Medicine, Vol. 8, pp. 4756, 2015, "Spheroid Formation and Evaluation of Hepatic Cells in a Three-Dimensional Culture Device"http://dx.doi.org/10.3727/215517915X689056
- 宮本 義孝, 池内 真志, 野口 洋文, 鈴木 聡, 八木 透, 生田 幸士, 林 衆治「培養デバイスTASCLによる初代肝細胞スフェロイド培養、および均一・大量生産系の確立」生体医工学/53 巻 (2015) Supplement号、https://doi.org/10.11239/jsmbe.53.S230_02
- 池内 真志, 豊田 悠司, 林 衆治, 生田 幸士、「気液透過性を付与したTASCLによるhiPS胚様体の高効率生産」生体医工学/53 巻 (2015) Supplement 号 https://doi.org/10.11239/jsmbe.53.S236_01
- Yoshitaka Miyamoto, Masashi Ikeuchi, Hirofumi Noguchi, Tohru Yagi, Shuji Hayashi, "Three-Dimensional In Vitro Hepatic Constructs Formed Using Combinatorial Tapered Stencil for Cluster Culture (TASCL) Device", Cell Med, 2014 Dec 12;7(2):67-74. doi:10.3727/215517914X685187.
- Oishi K, Miyamoto Y, Saito H, Murase K, Ono K, Sawada M, Watanabe M, Noguchi Y, Fujiwara T, Hayashi S, Noguchi H. In vivo imaging of transplanted islets labeled with a novel cationic nanoparticle. PLoS One. 2013;8(2):e57046. 2013
- Yukawa H, Watanabe M, Kaji N, Okamoto Y, Tokeshi M, Miyamoto Y, Noguchi H, Baba Y, Hayashi S. Monitoring transplanted adipose tissue-derived stem cells combined with heparin in the liver by fluorescence imaging using quantum dots. Biomaterials 33(7), 2177-2186. 2012
- Miyamoto Y, Oishi K, Yukawa H, Noguchi H, Sasaki M, Iwata H, Hayashi S. Cryopreservation of human adipose tissue-derived stem/progenitor cells using the silk protein sericin. Cell Transplant. 21(2-3), 617-622. 2012
- Hayashi T, Misawa H, Nakahara H, Noguchi H, Yoshida A, Kobayashi N, Tanaka M, Ozaki T. Transplantation of osteogenically differentiated mouse iPS cells for bone repair. Cell Transplant. 21(2-3), 591-600. 2012
- Naziruddin B, Matsumoto S, Noguchi H, Takita M, Shimoda M, Fujita Y, Chujo D, Tate C, Onaca N, Lamont J, Kobayashi N, Levy MF. Improved pancreatic islet isolation outcome in autologous transplantation for chronic pancreatitis. Cell Transplant. 21(2-3), 553-558. 2012
- Takita M, Matsumoto S, Noguchi H, Shimoda M, Ikemoto T, Chujo D, Tamura Y, Olsen GS, Naziruddin B, Purcell K, Onaca N, Levy MF. Adverse events in clinical islet transplantation: one institutional experience. Cell Transplant. 21(2-3), 547-551. 2012
- Noguchi H, Naziruddin B, Jackson A, Shimoda M, Ikemoto T, Fujita Y, Chujo D, Takita M, Peng H, Sugimoto K, Itoh T, Kobayashi N, Onaca N, Levy MF, Matsumoto S. Fresh islets are more effective for islet transplantation than cultured islets. Cell Tranaplant. 21(2-3), 517-523. 2012
- Noguchi H, Naziruddin B, Jackson A, Shimoda M, Fujita Y, Chujo D, Takita M, Peng H, Sugimoto K, Itoh T, Kobayashi N, Ueda M, Okitsu T, Iwanaga Y, Nagata H, Liu X, Kamiya H, Onaca N, Levy MF, Matsumoto S. Comparison of ulinastatin, gabexate mesilate, and nafamostat mesilate in preservation solution for islet isolation. Cell Transplant. 21(2-3), 509-516. 2012
- Shimoda M, Noguchi H, Fujita Y, Takita M, Ikemoto T, Chujo D, Naziruddin B, Levy MF, Kobayashi N, Grayburn PA, Matsumoto S. Islet purification method using large bottles effectively achieves high islet yield from pig pancreas. Cell Transplant. 21(2-3), 501-508. 2012
- Noguchi H, Naziruddin B, Shimoda M, Fujita Y, Chujo D, Takita M, Peng H, Sugimoto K, Itoh T, Kobayashi N, Onaca N, Levy MF, Matsumoto S. Evaluation of osmolality of density gradient for human islet purification. Cell Transplant. 21(2-3), 493-500. 2012
- Shimoda M, Noguchi H, Fujita Y, Takita M, Ikemoto T, Chujo D, Naziruddin B, Levy MF, Kobayashi N, Grayburn PA, Matsumoto S. Improvement of porcine islet isolation by inhibition of trypsin activity during pancreas preservation and digestion using α1-antitrypsin. Cell Transplant. 21(2-3), 465-471. 2012
- Takita M, Matsumoto S, Qin H, Noguchi H, Shimoda M, Chujo D, Itoh T, Sugimoto K, Onaca N, Naziruddin B, Levy MF. Secretory unit of islet transplant objects (SUITO) index can predict severity of hypoglycemic episodes in clinical islet cell transplantation. Cell Transplant. 21(1), 91-98. 2012
- Takasaki Y, Watanabe M, Yukawa H, Sabarudin A, Inagaki K, Kaji N, Okamoto Y, Tokeshi M, Miyamoto Y, Noguchi H, Umemura T, Hayashi S, Baba Y, Haraguchi H. "Estimation of the distribution of intravenously injected adipose tissue-derived stem cells labeled with quantum dots in mice organ through the determination of their metallic components by ICPMS" Anal. Chem. 83(21), 8252-8258. 2011
- Noguchi H. Pancreas procurement and preservation for islet transplantation: personal considerations. J. Transplant. 2011, 783168
- Ochiai K, Watanabe M, Ueki H, Huang P, Fujii Y, Nasu Y, Noguchi H, Hirata T, Sakaguchi M, Huh NH, Kashiwakura Y, Kaku H, Kumon H. Tumor suppressor REIC/Dkk-3 interacts with the dynein light chain, Tctex-1. Biochem. Biophys. Res. Commun. 412(2), 391-395. 2011
- Takita M, Matsumoto S, Noguchi H, Shimoda M, Chujo D, Itoh T, Sugimoto K, Sorelle JA, Onaca N, Naziruddin B, Levy MF. Cluster analysis of self-monitoring blood glucose assessments in clinical islet cell transplantation for type 1 diabetes. Diabetes Care 34(8), 1799-1803. 2011
- Yukawa H, Noguchi H, Hayashi S. "Embryonic body formation using the tapered soft stencil for cluster culture device. " Biomaterials 32(15), 3729-3738. 2011
- Yukawa H., Kagami Y., Watanabe M., Oishi K., Miyamoto Y., Okamoto Y., Tokeshi M., Kaji N., Noguchi H., Ono K., Sawada M., Baba Y., Hamajima N., Hayashi S. Quantum dots labeling using octa-arginine peptides for imaging of adipose tissue-derived stem cells. Biomaterials 31(14), 4094-4103. 2010
- Yukawa H., Noguchi H., Oishi K., Takagi S., Miyamoto Y., Hayashi S. Cell Transplantation of Adipose Tissue-Derived Stem Cells in Combination with Heparin Attenuated Acute Liver Failure in Mice. Cell Transplant. 18(5-6), 611-618. 2009
特許
TASCL関連の特許取得および出願状況は次の通りです。
1.任意の分布形状と分布密度を有する分子または粒子の集団を同時に多種大量生成する方法とその方法に使用するマスク材
出願番号:特願2008-237696(P2008-237696)
出願日:2008年9月17日
公開番号:特開2010-68728(P2010-68728A)
国際公開番号:WO 2010/032595 A1
出願人:独立行政法人科学技術振興機構
発明者:生田幸士、池内真志
2.細胞培養用シートおよびその製造方法
出願番号:特願2014-123483(P2014-123483)
出願日:2014年6月16日
公開番号:特開2016-2023(P2016-2023A)
出願人:日東電工株式会社,池内真志,一般財団法人グローバルヘルスケア財団
発明者:豊田悠司、池内真志、林衆治
3.細胞培養装置および細胞培養方法
出願番号:特願2014-232224(P2014-232224)
出願日:2014年11月14日
公開番号:特開2016-93149(P2016-93149A)
出願人:池内真志
発明者:池内真志、林衆治、豊田悠司